|
4 ハロゲン元素(17族元素)とその化合物
【ハロゲンの単体の製法】
|
|
塩素は酸化マンガン(Ⅳ)に濃塩酸を加えて加熱する①。
初めの洗気びんには〔 水 〕が入っていて,Cl2に混ざってくる水に溶解しやすい 〔 塩化水素HCl 〕ガスを吸収させる。次の洗気びんには〔 濃硫酸 〕が入っていて,混入する〔 水 〕を吸収する。また,塩素は空気よりも重いので〔 下方置換 〕で集める。
その他,塩素は塩化ナトリウム,酸化マンガン(Ⅳ),濃硫酸を加熱する②。さらし粉CaCl(ClO)・H2Oに塩酸を加える③。工業的には塩化ナトリウム水溶液の電気分解で得られる。臭素やヨウ素も塩素と同様の反応で得られる。 |
 |
|
|
|
① 〔 MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O 〕
(無機化学の反応式 パターン3 金属の化合物と塩酸 ⇒ その金属の塩化物+α) であるが,Cl2が出ることを覚えておくとよい。
② 〔 2NaCl + MnO2 + 3H2SO4 → 2NaHSO4 + MnSO4 + Cl2 + 2H2O 〕
(無機化学の反応式 パターン4 金属の化合物と硫酸 ⇒ その金属の硫酸塩+α)であるが,Cl2が出ること,NaHSO4であることを覚えておくとよい。
③ 〔 CaCl(ClO)・H2O + 2HCl → CaCl2 + Cl2 + 2H2O 〕
(無機化学の反応式 パターン3 金属の化合物と塩酸 ⇒ その金属の塩化物+α)であるが,Cl2が出ることを覚えておくとよい。
|
| 【単体の性質】 |
|
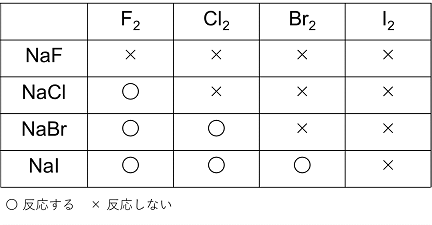
17族元素のハロゲンは価電子(最外殻電子)が〔 7 〕個であり,〔 1 〕価の陰イオンになりやすい。すなわち,ハロゲンの単体は電子を受け取りやすいので,酸化力があり,〔 漂白 〕・〔 殺菌 〕作用を示す。原子番号が小さいものほど反応性が大きく①,酸化力,漂白・殺菌力もF2>Cl2>Br2>I2の順である②。ハロゲンの単体はヨウ素以外はそれぞれ水と反応する③。塩素や臭素を水に溶かした溶液を塩素水や臭素水という。ヨウ素は〔 昇華 〕性のある結晶で,水には溶けにくいが,エタノールや〔 ヨウ化カリウム 〕水溶液には溶解する④。デンプン水溶液にヨウ素の溶液を加えると青色になる。この反応は〔 ヨウ素デンプン反応 〕と呼ばれ,ヨウ素やデンプンの検出に使われる。フッ素と塩素は〔 気 〕体でそれぞれ淡黄,黄緑,臭素は〔 液 〕体で赤褐色,ヨウ素は〔 固 〕体で黒紫である。
|
|
| ① F>Cl>Br>Iの順である。この順で最外殻がより内側になるので,より電子を引き付けるから。 |
|
② Br2よりもCl2の方が酸化力が強いので次の反応が起こる。
2NaBr + Cl2 → 2NaCl + Br2
Brの酸化数は-1から0へ変化(酸化されている)している。これは,Cl2の方が酸化力が強いためで,この逆の反応は起こらない。同様に,次の反応が起こるかどうかを考えることができる。 |
 |
|
③ ①の反応性の違いにより,F2はCl2,Br2と異なった反応になる。またI2は反応しない。
〔 2F2 + 2H2O → 4HF + O2 〕
〔 Cl2 + H2O ⇄ HClO + HCl 〕
〔 Br2 + H2O ⇄ HBrO + HBr 〕
④ I2は無極性分子なので,高極性の水には溶解せず,低極性の有機溶媒に溶解する。ヨウ化カリウムKI水溶液には,I-と結
合してI3-(三ヨウ化物イオン)となって溶解する。
|
|
【塩素のオキソ酸とその塩】
|
|
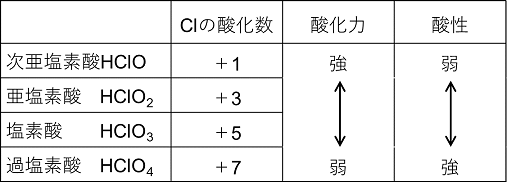
塩素のオキソ酸(分子中に酸素原子を含む酸)には,塩素原子の酸化数が異なるものがあり,酸化数が小さいほど,酸化力が〔 強 〕い。また酸素原子を多くもつものほど酸性が〔 強 〕い①。次亜塩素酸は〔 水溶液 〕中でのみ存在し,酸化力が強いので,〔 漂白 〕剤や〔 殺菌 〕剤に利用される。
湿った水酸化カルシウムに塩素を通じると,さらし粉〔 CaCl(ClO)・H2O 〕ができる。これを水に溶かすと,〔 CaCl2 〕と〔 Ca(ClO)2 〕の混合水溶液と同じ水溶液になる。このことから,さらし粉はこの2つの塩からなる複塩であることが分かる。さらし粉からCaCl2の成分を除いたCa(ClO)2・2H2Oを主成分とするものを 〔 高度さらし粉 〕といい,消毒・殺菌剤や漂白剤として利用されている。
|
|
| ① |
 |
|
【ハロゲン化水素】
|
|
塩化水素は実験室的には塩化ナトリウムに濃硫酸を作用させると発生する①。またフッ化水素はホタル石(フッ化カルシウムCaF2)に濃硫酸を加えて加熱すると発生する②。
フッ化水素以外のハロゲン化水素は常温常圧で無色の〔 気 〕体で水に溶けやすい。フッ化水素は常温常圧で,〔 液 〕体である。フッ化水素の水溶液はガラスを溶かす③。その他,フッ化水素は他のハロゲン化水素と次のような性質に違いが見られる。
|
|
|
一般に,分子構造が同じような物質では,分子量の大きなものほど,〔 ファンデルワールス力 〕が大きくなるので,沸点が高くなる。しかし,ハロゲン化水素の中でフッ化水素は,最も分子量が小さいにもかかわらず,沸点が高い。これはフッ化水素だけが分子間で〔 水素結合 〕するためである。また,フッ化水素だけが弱酸であるが,フッ化水素だけが水素結合をするため,H+が放出しにくくなるからである。 |
|
|
|
① 〔 NaCl + H2SO4 → NaHSO4 + HCl 〕 濃硫酸の不揮発性
② 〔 CaF2 + H2SO4 → CaSO4 + 2HF 〕 濃硫酸の不揮発
③ 〔 SiO2 + 6HF → H2SiF6 + 2H2O 〕H2SiF6ヘキサフルオロケイ酸
|
|
【ハロゲンの塩】
|
|
ハロゲンの塩は水に溶けやすいものが多いが,〔 Ag+ 〕,〔 Pb2+ 〕とハロゲン化物イオンからなる塩は水に溶けにくいものがある。銀イオンにハロゲン化物イオンを加えると,〔 フッ化銀AgF 〕以外のハロゲン化銀は水に溶けにくい沈殿が生成する①。塩化銀はアンモニア水と反応して錯イオン〔 [Ag(NH3)2]+ 〕となる(臭化銀,ヨウ化銀は反応しにくい)ハロゲン化銀は光分解しやすく,感光材に使われる。
|
|
|
① AgCl(白),AgBr(淡黄),AgI(黄)
|
 |